Nilalaman
- Pangunahing Pagkakaiba
- Protonasyon kumpara sa Deprotonation
- Tsart ng paghahambing
- Ano ang Protonation?
- Ano ang Deprotonation?
- Pangunahing Pagkakaiba
- Konklusyon
Pangunahing Pagkakaiba
Ang pangunahing pagkakaiba sa pagitan ng protonation at deprotonation ay ang protonation ay ang pagdaragdag ng isang proton sa isang compound ng kemikal, samantalang ang deprotonation ay ang pag-aalis ng isang proton mula sa isang compound ng kemikal.
Protonasyon kumpara sa Deprotonation
Ang protonation ay ang proseso ng kemikal na nangyayari sa mga reaksyon ng kemikal kung saan ang isang proton ay nagdaragdag sa isang compound ng kemikal; sa kabilang banda, ang deprotonation ay ang proseso na nangyayari sa panahon ng reaksiyong kemikal kung saan tinanggal ang proton mula sa isang compound ng kemikal. Ang protonation ay ang pagtaas sa +1 singil sa isang atom, molekula, ion, o isang tambalan; sa kabilang banda, ang deprotonation ay ang pagbawas sa +1 singil ng atom, ion, molekula, o isang tambalan.
Ang atom, molekula, o isang tambalan na kasangkot sa protonation ay tinatawag na base; sa flip side, ang atom, molekula o isang tambalan na kasangkot sa deprotonation ay tinatawag na acid. Ang protonation ay ang proseso kung saan tataas ang pH ng kemikal na tambalan; sa kabaligtaran, ang deprotonation ay ang proseso kung saan ang pH ng solusyon ng isang pagbawas sa compound ng kemikal.
Ang protonation ay ang proseso ng pagdaragdag, samantalang ang deprotonation ay ang pagtanggal o pag-alis ng proseso. Ang protonation ay ang proseso ng kemikal kung saan idinagdag ang enerhiya sa mga reaksyong kemikal; sa pitik na bahagi; ang deprotonation ay ang proseso ng kemikal kung saan inilabas ang enerhiya sa panahon ng mga reaksyon. Sa madaling salita, ang protonation ay ang pagdaragdag ng H+ sa compound ng kemikal; sa kabilang banda, ang deprotonation ay ang pagtanggal ng H+ mula sa isang compound ng kemikal.
Ang protonation ay nagdaragdag ng singil ng atom, ion, o isang molekula; sa flip side, binabawasan ng deprotonation ang singil ng ion, atom o isang molekula. Ang mga bas ay palaging sumasailalim sa mga proseso ng kemikal ng protonation sa panahon ng mga reaksyon ng acid-base; sa kabilang banda, ang mga acid ay palaging sumasailalim sa mga proseso ng kemikal ng pagkalbo sa panahon ng mga reaksyon ng acid-base.
Ang protonation ay ang proseso ng kemikal sa paggawa ng mga conjugate acid sa panahon ng mga proseso ng kemikal; sa pitik na bahagi; ang deprotonation ay ang proseso ng kemikal sa paggawa ng base ng conjugate sa proseso ng kemikal. Ang protonation ay laging nagiging sanhi ng paggawa ng mga molekula ng tubig mula sa mga pangkat ng hydroxyl ng compound sa mga proseso ng kemikal; sa gilid ng flip, ang deprotonation ay palaging nagiging sanhi ng paggawa ng mga molekula ng hydroxyl mula sa mga molekula ng tubig sa mga proseso ng kemikal.
Ang protonation ay isang napakabilis na proseso ng kemikal sa panahon ng mga organikong reaksyon; sa kabilang banda, ang deprotonation ay isang mabagal na proseso sa panahon ng mga organikong reaksyon. Ang protonation ay ang proseso ng kemikal na pinasisigla ang proseso ng isomerization, samantalang ang proseso ng kemikal na pinasisigla ang proseso ng isomerization. Ang protonation ay ang pagtaas ng rate ng acidic character; sa flip side, ang deprotonation ay ang pagtaas ng rate ng pangunahing karakter.
Tsart ng paghahambing
| Protonasyon | Deprotonation |
| Ang protonation ay ang pagdaragdag ng isang proton sa isang compound ng kemikal. | Ang deprotonation ay ang pag-aalis ng isang proton mula sa isang compound ng kemikal. |
| Proton | |
| Ang mga proton ay nagdaragdag sa isang compound | Ang mga proton ay tinanggal mula sa compound |
| Singilin | |
| Pinatataas nito ang +1 singil ng molekula | Binabawasan nito ang +1 singil ng molekula |
| Ang rate ng Acidity o Basicity | |
| Ang rate ng pagiging pangunahing | Ang rate ng kaasiman |
| Ang pH ng Compound | |
| Pinatataas nito ang pH ng tambalan | Binabawasan nito ang pH ng tambalan |
| Bilis ng Proseso | |
| Ito ay isang mabilis na proseso | Ito ay isang mabagal na proseso |
| Proseso ng Isomerization | |
| Pinasisigla ang proseso ng isomerization | Ipakita ang proseso ng isomerization |
| Ang Enerhiya ng Proseso | |
| Nagdaragdag ito ng enerhiya sa reaksyon | Inilabas nito ang enerhiya mula sa mga reaksyon |
| Uri ng Proseso | |
| Proseso ng pagdaragdag | Tinatanggal ang proseso |
| H+ Ion | |
| Ang mga hydrogen ion ay nagdaragdag sa compound | Ang mga hydrogen ion ay nag-aalis mula sa compound |
| Reversibility | |
| Ito ay ang mababalik na proseso | Ito ay hindi maibabalik na proseso |
| Kakayahang Catalytic | |
| Ito ay may kapangyarihang catalytic | Wala itong kapangyarihang catalytic |
Ano ang Protonation?
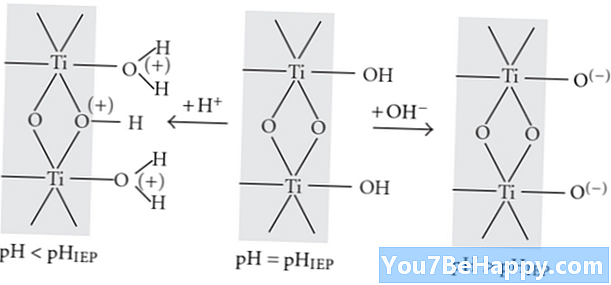
Ang protonation ay ang proseso ng kemikal ng pagdaragdag ng isang proton sa mga compound ng kemikal sa mga reaksyon ng kemikal. Ito ay isang napakabilis na proseso. Maaari itong mabuo ang mga molekula ng tubig mula sa mga molekula ng hydroxyl. Ang protonation ay ang nababaligtad na proseso na pinatataas ang singil ng compound ng kemikal sa pamamagitan ng isang rate ng +1 na singil sa isang atom, ion, molekula, o isang species.
Ang pH ng mga solusyon o mga solvent na kasangkot sa protonation ay napakababa. Ang protonation ay ang rate ng pangunahing o acidity ng kemikal o organikong mga compound. Ang protonation ay ang karagdagan o endothermic na proseso na kasangkot sa proseso ng isomerization. Pinasisigla din ang proseso ng polymerization.
Ito ay may kapangyarihang catalytic upang madagdagan ang kaasiman ng mga reaksyon na ginagamit sa maraming mga proseso tulad ng mga reaksyon ng karagdagan, nucleophilic, electrophilic reaksyon, pagpapalit ng reaksyon, atbp. Ang proseso ng protonation ay proporsyonal sa antas ng acidic character ng sangkap. Sa pangkalahatan ay nagsasangkot ito sa pagbuo ng mga molekula ng tubig sa panahon ng proseso.
Ang mga ion ng hydrogen ay palaging idinagdag sa compound ng kemikal sa panahon ng proseso ng protonation. Mayroon din itong kakayahang iiba-iba ang mga optical na katangian ng molekula. Ang proseso ng protonation ng mga compound ay nakasalalay sa kaasiman ng mga acid na magagamit sa mga solusyon o mga solvents. Ang proseso ng protonation ay ginagamit upang bawasan ang pagiging aktibo ng mga organikong molekula. Ang protonation sa pangkalahatan ay kilala bilang ang endothermic na proseso na nagsasangkot ng pagpapakawala ng enerhiya sa pamamagitan ng pagbibigay ng proton sa mga species ng kemikal.
Ang proseso tulad ng pagdaragdag ng hydrogen sa molekula ng ammonia na nagreresulta sa pagbuo ng mga ion ng ammonium, ang pagdaragdag ng mga hydrogen ions sa mga molekula ng tubig upang makabuo ng mga hydronons ion, ang protonation ng hydroxyl ion upang mabuo ang mga molekula ng tubig, ang pagdaragdag ng mga ion ng hydrogen sa mga alkohol upang mabuo ang mga hydrone ion sa solusyon, ang pagdaragdag ng mga hydrogen ion sa mga alkena at alkynes, atbp pinakamahusay na ipaliwanag ang term na protonation.
Ano ang Deprotonation?
Ang Deprotonation ay ang proseso ng kemikal ng pagtanggal ng mga proton mula sa mga compound ng kemikal sa panahon ng mga reaksyon ng kemikal. Ito ay isang mabagal na proseso. Ang prosesong ito ay mayroon ding kakayahang makabuo ng mga ion ng hydroxyl mula sa mga molekula ng tubig. Ang Deprotonation ay ang hindi maibabalik na proseso na may kakayahang bawasan ang singil ng compound ng kemikal sa pamamagitan ng isang rate ng +1 singil sa isang atom, molekula, o mga species ng ion.
Ang pH ng mga solusyon o mga solvent na kasangkot sa proseso ng deprotonation ay napakataas. Ang prosesong ito ay walang kakayahang magsagawa ng mga reaksiyong kemikal sa pamamagitan ng pagkilos bilang isang katalista. Ang proseso ng protonation ay proporsyonal sa pangunahing katangian ng sangkap. Ang mga ion ng hydrogen ay palaging nag-aalis mula sa kemikal na compound sa panahon ng proseso ng deprotonation. Ang mga optical na aktibidad nito ay variable din.
Ang proseso ng deprotonation ay nakasalalay din sa pH ng mga solusyon o solvents. Ang prosesong ito ay nagdaragdag ng reaktibo ng mga organikong molekula. Ang mga proseso tulad ng pag-alis ng mga hydrogen ion mula sa tubig upang makabuo ng mga hydroxyl ion, ang pag-alis ng isang proton mula sa alkanes upang mabuo ang mga alkena at alkynes, ang pag-alis ng mga hydrogen ion mula sa mga alkohol, atbp pinakamahusay na ipaliwanag ang term na pag-ubos.
Pangunahing Pagkakaiba
- Ang protonation ay ang kababalaghan ng karagdagan sa proton; sa kabilang banda, ang deprotonation ay ang kababalaghan ng pag-alis ng proton.
- Ang protonation ay palaging nagdaragdag ng pH ng kemikal na solusyon; sa gilid ng flip, ang deprotonation ay laging bumababa sa pH ng kemikal na solusyon.
- Ang protonation ay palaging nagdaragdag ng +1 singil sa kemikal na compound; sa kabilang banda, ang deprotonation ay palaging nagtatanggal ng +1 na singil sa compound ng kemikal.
- Ang protonation ay ang pagtaas ng rate ng acidic character; sa flip side, ang deprotonation ay ang pagtaas ng rate ng pangunahing karakter.
- Ang protonation ay nangyayari nang napakabilis; sa kabilang banda, ang pagdurog ay nangyayari nang napakabagal.
- Ang mga bas na karaniwang ginagamit sa proseso ng protonation sa pamamagitan ng pagtanggap ng proton; bagkos; pangkalahatang ginagamit ng deprotonation sa proseso ng deprotonation sa pamamagitan ng pagtanggal ng mga proton.
- Ang pagdaragdag ng enerhiya ay nangyayari sa proseso ng protonation; sa flip side, ang pag-alis ng enerhiya ay nangyayari sa proseso ng deprotonation.
- Ang protonation ay nagdaragdag ng singil ng atom, ion, o isang molekula; sa flip side, binabawasan ng deprotonation ang singil ng ion, atom o isang molekula.
- Ang proseso ng protonation ay nagsasangkot sa isomerization ng mga kemikal na sangkap; sa kabilang banda, ang proseso ng deprotonation ay hindi kasangkot sa isomerization ng mga kemikal na sangkap.
- Ang protonation ay ang proseso ng kemikal na nangyayari sa mga base sa panahon ng mga reaksyon ng acid-base; sa flip side, ang deprotonation ay ang proseso ng kemikal na nangyayari sa mga acid sa panahon ng mga reaksyon ng acid-base.
- Ang protonation ay palaging gumagawa ng conjugate acid sa proseso ng kemikal; sa kabaligtaran, ang deprotonation ay laging gumagawa ng base ng conjugate sa proseso ng kemikal.
- Ang protonation ay ginagawang mas puro ang solusyon; sa flip side, ginagawang mas kaunting puro ang solusyon.
- Ang protonation ay nagsasangkot sa paggawa ng mga molekula ng tubig; sa kabilang banda, ang deprotonation ay nagsasangkot sa paggawa ng mga molekula ng hydroxyl.
- Ang protonation ay ang endothermic na proseso; sa kabilang banda, ang deprotonation ay ang proseso ng exothermic.
Konklusyon
Ang talakayan sa itaas ay nagtatapos na ang protonation ay ang pagtaas sa +1 singil ng compound ng kemikal; sa kabilang banda, ang deprotonation ay ang pagbaba sa +1 singil ng compound ng kemikal.


